您現在的位置是:首頁 >人工智能 > 2022-07-05 16:59:18 來源:
新的篩選技術可以加速和改進mRNA治療
基于信使RNA或mRNA的療法可以潛在地治療多種疾病,包括癌癥、遺傳疾病,以及近年來世界所了解到的致命病毒。
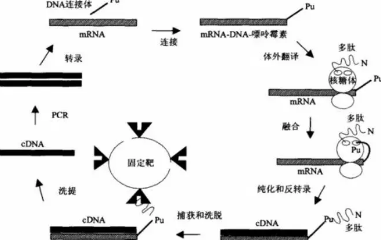
為了發揮作用,這些藥物必須直接輸送到稱為脂質納米顆粒或LNP的納米級脂肪氣泡中的靶細胞——如果不能到達正確的細胞類型,mRNA就不是很好。
佐治亞理工學院和埃默里大學醫學院的一組研究人員在改進這些定制運載工具的開發方面又邁出了一步,他們于6月30日在NatureNanotechnology上報告了他們的工作。JamesDahlman實驗室的實習生CurtisDobrowolski和KalinaPaunovska開發了一個系統,使臨床前納米粒子研究更具預測性。他們的發現已經在影響這個不斷發展的、競爭激烈的領域的研究方向。
“我對這項研究感到非常興奮,并預計我們未來的大部分項目都會轉向這種方法,”佐治亞理工學院和埃默里大學華萊士H.庫爾特生物醫學工程系副教授兼麥卡米什基金會早期職業教授Dahlman說。
事件排序
在過去的幾年里,Dahlman與CoulterBME教授PhilipSantangelo在一家繁忙的研究企業合作。Santangelo的實驗室開發mRNA療法,而Dahlman的實驗室使用LNP提供它。
為了加快測試LNP有效性的過程,Dahlman的團隊開發了一種稱為DNA條形碼的技術。在這個過程中,研究人員插入一段與給定LNP對應的DNA片段。然后注射LNP,隨后使用基因測序檢查細胞是否存在“條形碼”。該系統識別哪些條形碼已達到哪些特定目標,突出顯示最有前途的納米粒子。由于可以一次讀取許多DNA序列,條形碼過程允許同時進行許多實驗,從而加速了有效脂質納米顆粒載體的發現。
DNA條形碼顯著改善了納米顆粒的臨床前篩選過程。但仍然存在影響藥物輸送的重大障礙。由于它們的多樣性,細胞有點像移動的目標。Dahlman指出,以前被認為是同質的細胞是由不同的和不同的細胞亞群組成的。他的團隊推測,這種化學和遺傳異質性對LNP將mRNA療法傳遞到細胞中的效果具有強大的影響。
“細胞不只有一種蛋白質來定義它們——它們很復雜,”達爾曼說。“它們可以通過多種事物的組合來定義,如果我們說實話,最好使用它們表達或不表達的所有基因來定義它們。”
為了檢驗他們的假設,研究人員開發了一種新工具來一次測量所有這些東西。他們的多組納米粒子遞送系統被稱為單細胞納米粒子靶向測序,或SENT-seq。
多組學方法
使用SENT-seq,研究人員能夠量化LNP如何將DNA條形碼和mRNA傳遞到細胞中,隨后由mRNA藥物促進的蛋白質生產,以及數千個單個細胞中的細胞身份。
這種多組學方法可能代表高通量LNP發現的重要飛躍。SENT-seq技術使團隊能夠識別出表現出特別高或低納米顆粒攝取的細胞亞型,以及與這些亞型相關的基因。
因此,除了測試藥物的功效以及某些細胞亞型如何對納米粒子產生反應外,他們還在確定哪些基因參與了LNP的成功攝取。他們同時做這一切。
“數據表明,這些不同的細胞亞群對影響mRNA治療效果的納米顆粒有不同的反應,”Dahlman說。“還有很多工作要做,但我們認為能夠同時讀取高通量納米粒子傳遞和細胞對納米粒子的反應的能力將導致更好的mRNA治療。”
共同主要作者Paunovska說,她和Dobrowolski“經過兩個月的合作,有機地提出了SENT-seq系統的想法”。
Dahlman補充說:“我為Curtis、Kalina和團隊在實驗室所做的工作感到自豪。我認為這是我們工作中一個非常有趣階段的開始。”