您現在的位置是:首頁 >生活 > 2020-10-30 08:57:19 來源:
免疫系統受體被切斷可能調節細胞活性
導讀 麻省理工學院媒體實驗室的研究人員發現,與免疫相關的蛋白質受體的縮短版本,長期以來被認為是不完整的,因此無功能,可以與細胞膜上的天然
麻省理工學院媒體實驗室的研究人員發現,與免疫相關的蛋白質受體的縮短版本,長期以來被認為是不完整的,因此無功能,可以與細胞膜上的天然對應物結合,并可能代表新藥物,療法和仿生身體部位的途徑。
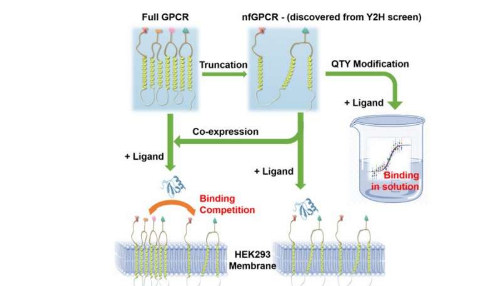
盡管以前認為具有截短結構的趨化因子受體在生物學上是無關緊要的,但在Cell Press的iScience期刊上發表的一篇論文報道,這兩種受體的截短版本CXCR4和CCR5與它們相應的配體結合并在蛋白質功能中起作用。
“這一出人意料的發現,即短受體可以識別其各自的配體,這有可能為生物學的新調節系統帶來新的前景。”媒體實驗室分子機器小組分子結構實驗室負責人,首席研究科學家張曙光說。 ,并且是該論文的高級作者。“這可能會激發研究人員提出被忽視的問題,并冒險超越當前的范式來發現,表征和設計蛋白質,并開發新技術和新醫學。”
Zhang用日常類比來描述縮短的受體的結合能力。
他說:“感受器就像我們拿著茶杯的手。” “你不需要五個手指就能握住它。兩個手指就足夠了。”
天然形式的截短的受體蛋白是非水溶性的,要保持其結構,需要使用去污劑,這使它們的研究變得困難。為了避免使用去污劑,研究人員不得不使用Zhang的QTY編碼將疏水性氨基酸替換為結構相似的親水性氨基酸,從而將受體蛋白轉化為水溶性形式。這一過程使研究人員能夠在不使用去污劑的情況下研究趨化因子受體的生理和功能特性。受體也被重新轉化為非水溶性形式以在體內觀察到。
截短的受體的重新轉化的天然變體不僅可以表達并將其自身定位在細胞膜上,以與它們各自的配體相互作用,而且還顯示出對全長受體的調節作用,阻止了它們到達細胞表面。張指出,這種現象需要進一步研究和試驗,但解釋了這種現象如何可能導致阻止癌癥等疾病的療法。



















